فسر سبب استخدام نظرية الحركة الجزئية لتفسير سلوك الغازات

تتواجد المادة في ثلاث حالات معروفة قد تكون صلبة أو سائلة أو غازية، وقد توصل العلم إلى العديد من الشروحات والنظريات التي تفسر كل حالة من هذه الحالات، وتعد الحالة الغازية للمادة من أصعب الحالات التي أحتار العلماء في دراستها وبذلوا فيها مجهود كبير حتى تم وضع نظرية الحركة الجزئية من أجل تفسير سلوك الغازات ووضع الفرضيات الخاصة بها.
ما هي النظرية الحركية الجزيئية للغازات
- تعمل النظرية الحركية للغازات على وضع التفسيرات المناسبة للسلوك الذي تسير من خلاله الغازات.
- وضعت النظرية فرضية معينة تفسر عمل الغازات بحيث تنص على إن الغازات تسير في خطوط مستقيمة.
- وقد يحدث تصادم في بعض الأحيان بين الجزيئات الخاصة بالغازات ولكن لا ينتج عن هذا التصادم أي نوع من فقدان الطاقة.
- يسمى التصادم الذي يحدث بين الجزيئات باسم التصادم المرن وهو يساعد في تنظيم حركة الجزيئات الخاصة بالغازات.
- تنفي النظرية وجود أي نوع من التجاذب بين الجزيئات الخاصة بالغازات ويرجع ذلك إلى بعدها عن بعضها البعض.
- تصف النظرية حركة جزيئات الغازات بأنها عشوائية أي غير منضبطة نتيجة تكونها في درجة حرارة معينة.
- تؤثر درجة الحرارة المعينة على سرعة الغازات كما تتأثر حركة الغازات بوزن الجزيء الواحد.
- وهذا ما يفسر زيادة سرعة الجزيئات الخفيفة عن الجزيئات الثقيلة عند وضعهما في نفس درجة الحرارة.
- وأكبر مثال على ذلك تزداد سرعة جزيئات الهيدروجين الخفيفة مقارنة بجزيئات الأكسجين الثقيلة عند وضعهما في نفس درجة الحرارة.

شاهد أيضًا: نظرية التعلم البنائية ومبادئها
ما هي فروض نظرية الحركة الجزئية للغازات
وضعت نظرية الحركة الجزئية مجموعة من الفروض الهامة التي تفسر حركة الغازات بطريقة علمية، وتتمثل أهم هذه الفروض في:
- الغاز هو عبارة عن مجموعة من الجسيمات الصغيرة التي تشغل حجم أصغر بكثير في حالة اجتماعها معًا.
- وهذا يوضح كبر المسافة بين كل جسيم وأخر مقارنة بحجم الجسيم نفسه لذلك يؤدي اجتماعهم معًا إلى صغر الحيز الخاص بهم.
- تشترك الجسيمات التي يتكون منها الغاز في نفس الكتلة.
- كما ذكرنا من قبل القوة بين جزيئات الغاز تقتصر على التصادم فقط حيث لا يوجد بينهم أي قوة تجاذب.
- تتحرك جزيئات الغاز بشكل مستمر حركة سريعة وعشوائية.
- يتكون الغاز من عدد كبير جدًا من الجزيئات حيث لا يمكن تقديرها احصائيًا.
سبب استخدام نظرية الحركة الجزئية لتفسير سلوك الغازات
يتم استخدام نظرية الحركة الجزئية لتفسير سلوك الغازات نظرًا لأن الفروض الخاصة بالنظرية التي شرحناها لكم تنطبق على سلوك الغازات وحركتها وذلك على النحو التالي:
- تتكون الغازات من جزيئات صغيرة كروية تبتعد عن بعضها البعض كما تتحرك بشكل مستمر في اتجاه مستقيم.
- ينتج عن هذه الحركة عملية تصادم بين الجزيئات حيث تصطدم بالوعاء الذي يحفظها.
- يُعرف هذا التصادم باسم التصادم المرن.
- هذا ما يفسر استخدام نظرية الحركة الجزيئة لتفسير سلوك الغازات دون الأجسام الصلبة أو السائلة.
- ويرجع ذلك إلى إن الأجسام الغازية تتباعد عن بعضها بشكل كبير دون الأجسام الصلبة والسائلة كما تتصادم جزيئات الغاز بشكل مرن لا ينتج عنه أي فقدان للطاقة.
شاهد أيضًا: بحث شامل عن نظرية الكم
نتائج نظرية الحركة الجزئية للغازات
هناك بعض النتائج التي تم التوصل إليها استنادًا إلى الفروض الموضوعة لنظرية الحركة الجزئية، وتتمثل هذه النتائج في:
- يمكن التعامل مع حركة جزيئات الغاز من خلال الميكانيكا الكلاسيكية.
- نتج عن الفروض إمكانية تجاهل ميكانيكا الكم وذلك يرجع إلى زيادة المسافة بين جزيئات الغاز بشكل أكبر بكثير من الطول الموجي لذلك تعتبر أشياء عادية يمكن التغاضي عنها.
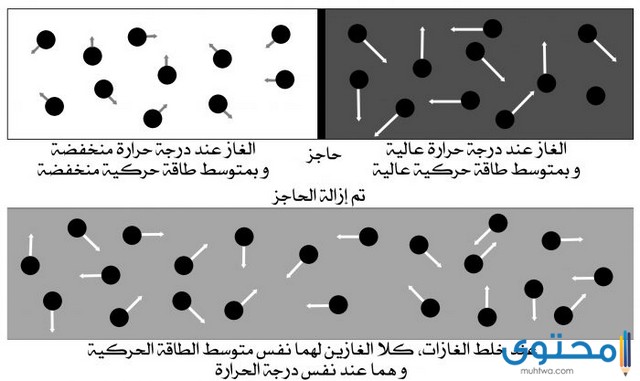
- تتوقف الطاقة الناتجة عن حركة الجزيئات على درجة الحرارة فقط.
- يؤثر حجم الجزيئات أيضًا على حركتها حيث إن الجزيئات الخفيفة تعد أسرع من الجزيئات الأثقل في حال كانت درجة الحرارة واحدة.
- يمكن تجاهل الوقت المقدر لتصادم الجسيمات بجدار الحاوية نظرًا لأنه صغير جدًا مقارنة بوقت الاصطدامات المتتالية.
ما هي قوانين حركة جزيئات الغاز
وضعت نظرية الحركة الجزئية مجموعة من القوانين التي تفسر حركة جزيئات الغاز والتي سوف نستعرضها معكم فيما يلي:
تأثير زيادة الحجم مع درجة حرارة ثابتة
- في حالة كان درجة الحرارة التي يتعرض لها الغاز ثابتة تظل أيضًا متوسط حركة جزيئات الغاز ثابتة ولا تتغير.
- ولكن تؤثر زيادة الحجم على حركة جزيئات الغاز حيث يؤدي إلى تحريكها مسافة أطول بين الاصطدامات.
- يتسبب ذلك في تراجع معدل الاصطدام بين جدران الوعاء مما ينتج عنه انخفاض في الضغط.
زيادة درجة الحرارة مع ثبات الحجم
- تتسبب درجة الحرارة العالية في زيادة متوسط الطاقة الحركية للجسيمات.
- في حالة كان الحجم الخاص بجزيئات الغاز ثابت ينتج عنه حدوث المزيد من التصادمات بين جزيئات الغاز وجدران الوعاء ومن ثم تفسر النظرية زيادة الضغط في هذه الحالة.
شاهد أيضًا: أي الغازات الآتية يسبب تكون المطر الحمضي
السمات العامة للغازات
توجد بعض الخصائص والسمات العامة التي تميز الغازات، وهي تتمثل في:
- يتكون الغاز في الحقيقة من الفراغ نظرًا لصغر حجم الجزيئات الخاصة به إضافة إلى كبر حجم المسافة بينهم.
- كما إن الروابط التي تصل بين هذه الجزيئات تعد ضعيفة جدًا مما يتسبب في قلة كثافة الغاز وتبخره في الجو.
- تتسم الغازات بالقدرة على التمدد والضغط وهذا ما يفسر السبب وراء وضع كمية صغيرة من الغاز في حاوية كبيرة حيث إنها تتمدد وتضغط على الحاوية الموجودة فيها.
- الغاز من المواد القادرة على التدفق والانتشار بشكل سريع وهائل نظرًا لأن سرعة جزيئاتها غير ثابتة.
