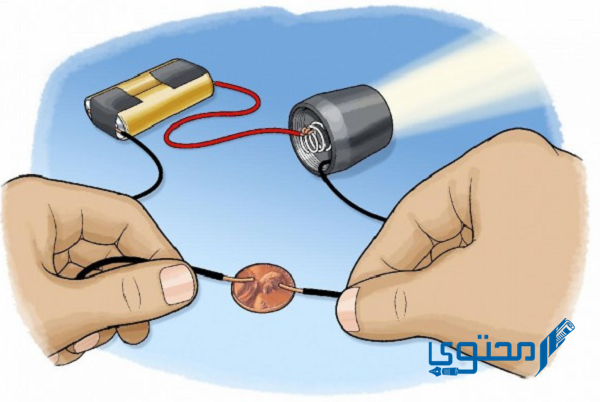
توصيل الحرارة والكهرباء صفة مشتركة بين جميع الفلزات

إن العناصر الفلزية تشترك كلها معًا بذات الصفات، من بينها توصيل الحرارة والكهرباء، وتعداد هذه الفلزات بالجدول الدوري كبير فيصل نحو ثلاثة أرباع عناصر الجدول الدوري .
ولأن هذه العناصر سريعة التفاعل الكيميائي يصعب على العملاء إيجادها بشكل صريح وخام، فيما عدا عناصر مثل النحاس والذهب والفضة، إذ توجد نقية بالطبيعة.
لا يفوتك أيضًا: الخصائص المميزة لأشباه الفلزات أنها شبه موصلة للتيار الكهربائي والحرارة
خصائص الفلزات
استكمالًا لحديثنا عن توصيل الحرارة والكهرباء صفة مشتركة بين جميع الفلزات، فهذه العناصر لاريب أنها تحوي الكثير من الخصائص الأخرى، تلك التي تجعل منها متميزة عن غيرها، ومن بينها:
- يمكن طرقها دون أن تتفتت، مما يجعل تشكيلها سهلًا جدًا.
- الفلزات لينة جدًا إذا ما تم رفع درجة حرارتها، إلا أنها بذات الوقت شديدة الصلابة إذا تم تبريدها.
- لامعة جدًا، مما يجعلها شديدة البريق.
- من المعادن عالية الرنين إذا ما تم هزها بقوة، لهذا السبب يكثر استخدامها في الأجراس.
- على الرغم من ن أنم لا صخحصخيلاىدجأن ليس كلها يتفاعل مع الماء، إلا أن الأنشطة منها تتفاعل مع الماء مكونة طاقة حرارية كما يفعل الصوديوم.
- يمكن الكشف عنها من خلال تفاعلاتها مع الأحماض، لأنها تكون نتيجة لهذا غاز الهيدروجين، مثل الزنك الذي إذا تفاعل مع حمض الهيدروكلوريك ينتج عنه كلوريد الزنك وغاز الهيدروجين.
- على الرغم من أنه ليس كل الفلزات تتفاعل مع القواعد، إلا أن هذا التفاعل ينتج عنه الأملاح المعدنية وغاز الهيدروجين.
- حين تُضاف الفلزات إلى الأكسجين ينتج عنها أكاسيد الفلزات.
- مشكلتها أنها تُأكسد بسهولة، الأمر الذي يعرضها للصدأ.
أنواع الفلزات
على الرغم من أن خواصها متقاربة، توصيل الحرارة والكهرباء صفة مشتركة بين جميع الفلزات، إلا أنه يوجد بعض التصنيفات لهذه العناصر كالتالي:
| النوع | العناصر |
| الفلزات القلوية | العناصر يسار جدول الدوري، كالليثيوم، والصوديوم، والبوتاسيوم، والروبيديوم، والهيدروجين. |
| الفلزات القلوية الترابية | بالمجموعة الثانية من الجدول، مثل البريليوم والماغنيسيوم، والكالسيوم، والباريوم والراديوم. |
| الفلزات الأساسية | الألومنيوم، والغاليوم، والثاليوم، والرصاص. |
| الفلزات الانتقالية | كالذهب والفضة والتيتانيوم. |
لا يفوتك أيضًا: موضوع عن الفلزات واللافلزات
استخدامات العناصر الفلزية
في إطار الحديث عن توصيل الحرارة والكهرباء صفة مشتركة بين جميع الفلزات، فهذه الخاصية التي تتصف بها هذه العناصر هي ما تأخذنا للاستخدامات الكثيرة لها وهي كالتالي:
- تدخل في صناعة الأواني التي توضع في الفرن، وصناعة الأفران نفسها، والكثير من الأجهزة الكهربائية، مثل المكانس والخلاطات.
- الإلكترونيات مثل الآلات الحاسبة، وأجهزة الكمبيوتر والهواتف.
- هامة في البناء جدًا.
- صناعة وسائل المواصلات، مثل السفن، والشاحنات، والطائرات، والسيارات.
- عنصر أساسي في صناعة الآلات الكهربائية، والمفاعلات النووية.
- صناعة الأطراف الصناعية.
- تُصنع منها الصواريخ التي تُسافر إلى الفضاء.
ما هي اللافلزات؟
هي المواد التي ليس بها الخصائص التي تتميز بها المواد الفلزية، فهي ليست لامعة ولا صلبة ولا توصل الحرارة أو التيار الكهربي، ومن أمثلتها الكربون والهيدروجين والفوسفور، وعلى الرغم من الفائدة المحددة لها إلا أنها توجد في القشرة الأرضية بكمية كبيرة جدًا، كما هُناك قدرٌ كبير منها من الغازات.
خصائص اللافلزات
توصيل الحرارة والكهرباء صفة مشتركة بين جميع الفلزات، إلا أنها لا تشترك بها اللافلزات، حيث تتميز بأنها لا توصل الحرارة ولا التيار الكهربي مطلقًا، لهذا يستخدم في صناعة أجزاء من الأواني كي لا تسبب الأذى، إضافة إلى الغلاف الخارجي للأسلاك الكهربية، ومن الخصائص الأخرى للافلزات:
- غاز الجرافيت والكربون على العكس من باقي اللافلزات، إذ أنهما يوصلان الحرارة والكهرباء لكن بشكل ضعيف جدًا.
- لا يمكن طيها أو تشكيلها، فهي غير صلبة على الإطلاق.
- القدرة على التفاعل مع الفلزات عالية جدًا، على العكس من تفاعلاتها معًا التي تحتاج إلى درجة حرارة كبيرة جدًا.
- إذا ما تُركت اللافلزات في الهواء فمن الصعب أن تتفاعل مع أي غاز أو مؤثر خارجي.
- لا تتفاعل مطلقًا مع المار، باستثناء الكلور الوحيد الذي يذوب في الماء محولًا إياه إلى محلول ملحي.
- لون أغلبها يميل إلى الأسود.
- السالبية الكهربية لديها عالية جدًا.
- حين تتفاعل مع الأكسجين تنتج أكاسيد حمضية.
- عدد إلكترونات تكافؤ غلافها الخارجي أكثر من 4.
- الحجم الذري لها صغير جدًا.
- إذا ما طرق عليها فهي لا تُصدر أي رنين.
لا يفوتك أيضًا: شرح درس الجدول الدوري الحديث
ما هي عناصر الجدول الدوري؟

يوجد بالجدول الكثير من العناصر، لدى كلٍ منها الكثير من الاستخدامات، بعضها فلزات، والبعض الآخر لا فلزات، وبعضها غازات، وعلى الطالب الذي يدرس العناصر الكيميائية أن يتعرف على كافة رموزها، وهي المتمثلة في النقاط التالية:
- البوريوم Bh
- السيبورجيوم Sg
- الدارمشتاتيوم Ds
- الهاسيوم Hs
- البورون B
- الليثيوم Li
- الهيليوم He
- النيتروجين N
- البيريليوم Be
- الهيدروجين H
- الكربون C
- النيون Ne
- الأكسجين O
- الفلور F
- الألومنيوم Al
- الصوديوم Na
- المغنسيوم Mg
- الكبريت S
- السيليكون Si
- الفوسفور P
- البوتاسيوم K
- الكلور Cl
- الكالسيوم Ca
- السكانديوم Sc
- المنغنيز Mn
- الفاناديوم V
- الكروم Cr
- النيكل Ni
- الحديد Fe
- الكوبالت Co
- الغاليوم Ga
- النحاس Cu
- المايتنريوم Mt
- الكوبرنيسيوم Cn
- الرونتجينيوم Rg
- الفليروفيوم Fl
- النيهونيوم Nh
- الليفرموريوم Lv
- الموسكوفيوم Mc
- الأوغانيسون Og
- التينيسين Ts
- الأرغون Ar
- التيتانيوم Ti
- الزنك Zn
- السيلينيوم Se
- الجرمانيوم Ge
- الزرنيخ As
- الكريبتون Kr
- البروم Br
- الإتريوم Y
- الروبيديوم Rb
- السترونشيوم Sr
- الموليبدنوم Mo
- الزركونيوم Zr
- النيوبيوم Nb
- الروثينيوم Ru
- التكنيشيوم Tc
- الفضة Ag
- الروديوم Rh
- البالاديوم Pd
- القصدير Sn
- الكادميوم Cd
- الإنديوم In
- اليود I
- الإثمد Sb
- التيلوريوم Te
- الباريوم Ba
- الزينون Xe
- السيزيوم Cs
- البراسيوديميوم Pr
- اللانثانوم La
- السيريوم Ce
- الساماريوم Sm
- النيوديميوم Nd
- البروميثيوم Pm
- التيربيوم Tb
- اليوروبيوم Eu
- الغادولينيوم Gd
- الإربيوم Er
- الديسبروسيوم Dy
- الهولميوم Ho
- اللوتيتيوم Lu
- الثوليوم Tm
- الإتيربيوم Yb
- الرصاص Pb
- الثاليوم Tl
- الأستاتين At
- البزموت Bi
- البولونيوم Po
- الفرانسيوم Fr
- الرادون Rn
- الأكتينيوم Ac
- الراديوم Ra
- اليورانيوم U
- الثوريوم Th
- التانتالوم Ta
- الهافنيوم Hf
- الرينيوم Re
- التنغستن W
- الإريديوم Ir
- الأوزميوم Os
- الزئبق Hg
- البلاتين Pt
- الذهب Au
- الكاليفورنيوم Cf
- المندليفيوم Md
- الفرميوم Fm
- اللورنسيوم Lr
- النوبليوم No
- الدوبنيوم Db
- الرذرفورديوم Rf
- البروتكتينيوم Pa
- البلوتونيوم Pu
- النبتونيوم Np
- الكوريوم Cm
- الأمريكيوم Am
- الأينشتاينيوم Es
- البركليوم Bk
إن الفلزات لها الكثير من الصفات التي تميزها عن غيرها من العناصر في الجدول الدوري، فالصناعات التي تدخل بها كثيرة جدًا.
